




本公司所有产品仅供科学实验,不做其他科学实验外的使用!
产品名称 | 人冠状动脉平滑肌细胞 | 组织来源 | 冠状动脉 |
规格 | 5×10⁵Cells/T25培养瓶 | 包装 | T25培养瓶 |
货号 | GOY-01X1189 | 细胞形态 | 成纤维细胞样 |

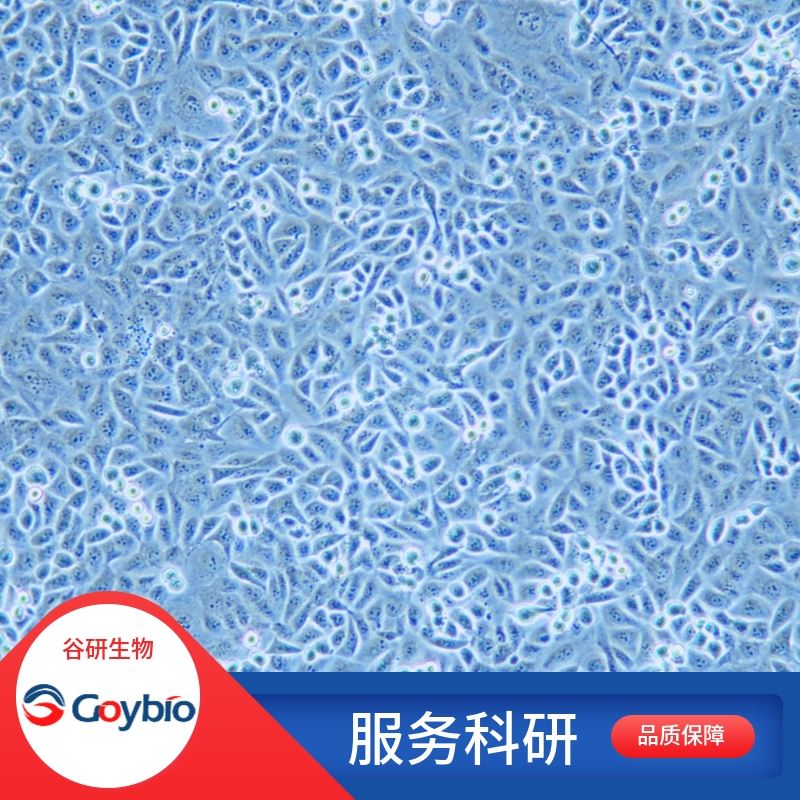
人冠状动脉平滑肌分离自冠状动脉组织;冠状动脉是供给心脏血液的动脉,起于主动脉根部,分左右两支,行于心脏表面。采用Schlesinger等的分类原则,将冠状动脉的分布分为三型:右优势型、均衡型、左优势型。左右冠状动脉是升主动脉的对分支。左冠状动脉为一短干,发自左主动脉窦,经肺动脉起始部和左心耳之间,沿冠状沟向左前方行后,立即分为前室间支和旋支。前室间支沿前室间沟下行,旋支绕过心尖切迹至心的膈面与右冠状动脉的后室间支相吻合。它是构成冠状动脉壁的主要细胞成分,细胞膜上分布着多种离子通道,如电压依赖性Na+通道、多种Ca2+通道和K+通道;它们参与了静息电位的维持与细胞膜电位的复极化、超极化,调节血管平滑肌的收缩及舒张功能,此外动脉粥样硬化的发展也涉及冠状动脉平滑肌细胞增殖、炎症及凋亡等。因此,原代分离培养的冠状动脉平滑肌细胞,对研究生理和病理状态下离子通道及血管张力变化机制具有非常重要的作用。冠状动脉平滑肌细胞原代分离培养3天后,可见细胞贴壁伸展,细胞形态大小不一,呈梭形、不规则形、三角形或扇形,核卵圆形、居中;2周后细胞汇合,多数细胞伸展呈长梭形,胞浆丰富,有分枝状突起,细胞平行排列成单层或部分区域多层重叠生长,高低起伏;细胞密度低时,常交织成网状;密度高时,则排列为旋涡状或栅栏状。传代后细胞生长较快,4-6天即可汇合,并保持上述形态学特征和生长特点。
方法简介:
公司实验室分离的人冠状动脉平滑肌采用yi蛋白酶-胶原酶联合消化法结合差速贴壁法制备而来,细胞总量约为5×10?cells/瓶。
质量检测:
公司实验室分离的人冠状动脉平滑肌经α-SMA免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。


培养基 含FBS、生长添加剂、Penicillin、Streptomycin等
换液频率 每2-3天换液一次
生长特性 贴壁
细胞形态 成纤维细胞样
传代特性 可传5代左右;3代以内状态好
消化液 0.25%yi蛋白酶
培养条件 气相:空气,95%;CO2,5%
![]()
准备工作
1. 实验器材准备:准备无菌的培养皿、培养瓶、移液管、离心管、手术器械等,并进行高压灭菌或其他合适的消毒处理。
2. 试剂准备:配制或购买合适的培养基、消化酶(如、胶原酶等)、胎牛血清、双抗等试剂,确保其无菌且在有效期内。
3. 实验动物或组织来源准备:根据实验需求,选择合适的动物并进行相应的麻醉或处死,获取所需组织;或从已有的组织样本库中获取组织。
取材与处理
1. 取材:在无菌条件下,迅速取出目标组织,尽量减少对组织的损伤,并去除多余的脂肪、结缔组织等非目的组织。
2. 清洗:将取出的组织用预冷的无菌PBS冲洗数次,以去除血液和杂质。
3. 剪切:将组织剪成约1 - 2mm³的小块,以便后续消化。
细胞分离
1. 消化:将剪碎的组织块放入含有适量消化酶的离心管中,在37℃恒温摇床或培养箱中消化一段时间。期间可轻轻摇晃离心管,使消化更均匀。
2. 终止消化:当组织块大部分被消化成单细胞悬液或小细胞团时,加入含血清的培养基终止消化。
3. 过滤与离心:用细胞筛过滤细胞悬液,去除未消化的组织碎片,然后将滤液以适当的转速离心,收集细胞沉淀。
细胞观察与检测
1. 日常观察:每天用倒置显微镜观察细胞的形态、生长状态、密度等,记录细胞的变化情况,如发现细胞污染或异常,及时采取相应措施。
2. 细胞计数与活力检测:在需要时,可采用台盼蓝染色等方法对细胞进行计数和活力检测,以了解细胞的生长情况和健康状态。


小鼠胚胎成纤维细胞;3T3-Swissalbino | 二氢还原缺陷型中国仓鼠卵巢细胞;CHO/dhFr- |
小鼠垂体瘤细胞;GT1-1 | 胆盐硫乳琼脂培养基(DHL) |
人前列腺癌细胞;DU145[DU145;DU-145] | 低聚半乳糖 |
人胚肾细胞;293[HEK-293] | Levo大容量手动移液器(绿) |
人肺癌细胞;A549[A-549] | Levo大容量手动移液器(红) |
小鼠胚胎成骨细胞前体细胞;MC3T3-E1 | Levo大容量手动移液器(黄) |
人乳腺癌细胞;MCF7 | 3.0um过滤器,适用Levo |
大鼠角膜基质细胞 | Levo Plus大容量电动移液器 |
人乳腺癌细胞;MDA-MB-453 | 四硫磺钠亮绿培养基(TTB)基础(药典) |
小鼠神经母细胞瘤细胞与大鼠胶质瘤细胞之融合细胞;NG108-15[108CC15] | 尿琼脂基础(pH7.2) |
小鼠睾丸畸胎瘤细胞;P19 | 三糖铁(TSI)琼脂 |
人恶性多发性畸胎瘤细胞;NTERA-2 | HE琼脂 |
人卵巢畸胎瘤细胞;PA-1 | 人冠状动脉平滑肌细胞亚硫铋(BS)琼脂 |
小鼠胚胎成纤维细胞;NIH/3T3 | 3-(4-溴苯基)吡咯烷 |
4’,6-二脒基-2-苯基吲哚 DAPI | 2--1-(2-羟基-4,6-二甲氧苯基)乙酮 |

一、取材与分离
1. 快速操作
- 组织取材后需立即处理,避免长时间暴露于室温或非营养环境。
- 使用无菌 PBS 或生理盐水冲洗组织,去除血液、杂质。
2. 消化酶选择
- 根据组织类型选择消化酶,避免过度消化导致细胞损伤。
- 消化时间需严格控制(通常 10-30 分钟),可通过显微镜观察细胞解离状态。
二、培养条件优化
1. 培养基选择
- 使用含血清或特定生长因子的培养基(如 DMEM、RPMI 1640 等),部分细胞需添加胰岛素、EGF 等。
- 避免频繁更换培养基品牌或批次,减少细胞适应压力。
2. 贴壁与传代
- 原代细胞贴壁能力较弱,可能需要包被培养皿(如胶原蛋白、多聚赖氨酸)。
- 传代时密度建议控制在 70%-80%,过度汇合会导致接触抑制和分化。
三、污染控制
1. 无菌操作
- 全程在超净台操作,使用一次性耗材,避免交叉污染。
- 培养基中可添加双抗,但长期使用可能影响细胞活性。
2. 支原体检测
- 定期检测支原体污染(如 PCR 法),污染后需及时丢弃细胞。
四、状态监控
1. 日常观察
- 每天检查细胞形态、密度及培养基颜色,及时更换培养基(通常每 2-3 天换液一次)。
- 异常形态(如细胞变圆、碎片增多)可能提示污染或营养不足。
2. 传代与冻存
- 原代细胞分裂次数有限(一般 5-10 代),需及时冻存早期代次细胞。
- 冻存液建议使用 DMSO+血清(或专用冻存培养基),梯度降温后液氮保存。