




本公司所有产品仅供科学实验,不做其他科学实验外的使用!
产品名称 | 人小肠黏膜上皮细胞 | 组织来源 | 小肠组织 |
规格 | 5×10⁵Cells/T25培养瓶 | 包装 | T25培养瓶 |
货号 | GOY-01X0836 | 细胞形态 | 上皮细胞样 |

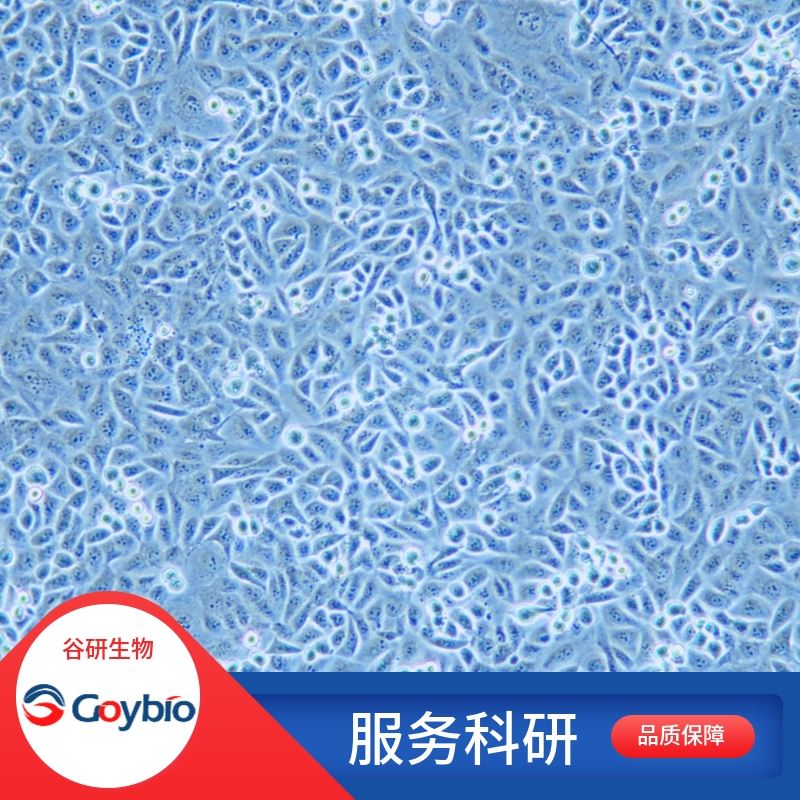
人小肠黏膜上皮分离自小肠组织;小肠位于腹中,上端接幽门与胃相通,下端通过阑门与大肠相连,是食物消化吸收的主要场所。小肠盘曲于腹腔内,上连胃幽门,下接盲肠,分为十二指肠、空肠和回肠三部分。小肠内消化是至关重要的,因为食物经过小肠内胰液、胆汁和小肠液的化学性消化及小肠运动的机械性消化后,基本上完成了消化过程,同时营养物质被小肠粘膜吸收了。小肠管壁由粘膜、粘膜下层、肌层和浆膜构成。其结构特点是管壁有环形皱襞,粘膜有许多绒毛,绒毛根部的上皮下陷至固有层,形成管状的肠腺,其开口位于绒毛根部之间。绒毛和肠腺与小肠的消化和吸收功能关系密切;构成肠腺的细胞有柱状细胞、杯状细胞、潘氏细胞和未分化细胞。柱状细胞和内分泌细胞与绒毛上皮相似,接近绒毛的柱状细胞与吸收细胞相似,绒毛深部的柱状细胞微绒毛少而短,不形成纹状缘。小肠有三种功能即消化、吸收和分泌及运动功能,其中以吸收和分泌功能为主。平滑肌细胞的收缩是负责肠蠕动的动力,促使食物向下运动。肠黏膜上皮细胞是机体内外环境的重要屏障,持续暴露于大量抗原中,也是机体面对病原微生物的道防线。因此,肠黏膜上皮细胞除有吸收、分泌和转运等重要生理功能之外,在黏膜先天性和获得性免疫防御机制中也起着重要作用。肠黏膜上皮细胞作为首先接触抗原的细胞,在黏膜免疫反应的起始阶段发挥关键作用,它决定黏膜免疫反应的发生、性质和强度。
方法简介:
公司实验室分离的人小肠黏膜上皮采用先机械分离法、后胶原酶消化法并通过上皮细胞专用培养基培养筛选制备而来,细胞总量约为5×10?cells/瓶。
质量检测:
公司实验室分离的人小肠黏膜上皮经Cytokeratin-18免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。


包被条件 鼠尾胶原Ⅰ(2-5μg/cm2)
培养基 含FBS、生长添加剂、Penicillin、Streptomycin等
换液频率 每2-3天换液一次
生长特性 贴壁
细胞形态 上皮细胞样
传代特性 可传2-3代
消化液 0.25%yi蛋白酶
培养条件 气相:空气,95%;CO2,5%
![]()
准备工作
1. 实验器材准备:准备无菌的培养皿、培养瓶、移液管、离心管、手术器械等,并进行高压灭菌或其他合适的消毒处理。
2. 试剂准备:配制或购买合适的培养基、消化酶(如、胶原酶等)、胎牛血清、双抗等试剂,确保其无菌且在有效期内。
3. 实验动物或组织来源准备:根据实验需求,选择合适的动物并进行相应的麻醉或处死,获取所需组织;或从已有的组织样本库中获取组织。
取材与处理
1. 取材:在无菌条件下,迅速取出目标组织,尽量减少对组织的损伤,并去除多余的脂肪、结缔组织等非目的组织。
2. 清洗:将取出的组织用预冷的无菌PBS冲洗数次,以去除血液和杂质。
3. 剪切:将组织剪成约1 - 2mm³的小块,以便后续消化。
细胞分离
1. 消化:将剪碎的组织块放入含有适量消化酶的离心管中,在37℃恒温摇床或培养箱中消化一段时间。期间可轻轻摇晃离心管,使消化更均匀。
2. 终止消化:当组织块大部分被消化成单细胞悬液或小细胞团时,加入含血清的培养基终止消化。
3. 过滤与离心:用细胞筛过滤细胞悬液,去除未消化的组织碎片,然后将滤液以适当的转速离心,收集细胞沉淀。
细胞观察与检测
1. 日常观察:每天用倒置显微镜观察细胞的形态、生长状态、密度等,记录细胞的变化情况,如发现细胞污染或异常,及时采取相应措施。
2. 细胞计数与活力检测:在需要时,可采用台盼蓝染色等方法对细胞进行计数和活力检测,以了解细胞的生长情况和健康状态。


人胚胎膀胱组织来源细胞 | 人胚胎气管组织来源细胞 |
人胚肾二倍体细胞 | APES防脱剂 |
胎儿骨髓间充质细胞(自建) | L-谷氨钠 |
人皮肤成纤维细胞 | L-组氨盐酸盐 |
人脐静脉内皮细胞 | 甘氨二肽 |
人男性正常龟头细胞 | 4-氯-1-萘酚 |
人腹膜微血管内皮细胞 | 2,6-二氯酚靛酚钠 |
DMEM/F12培养基: | 多聚-L-赖氨酸(3-7万) |
人肺微血管内皮细胞 | 亲和 |
人脐带动脉内皮细胞 | L-半胱氨 |
人小肠上皮细胞 | 异硫氰酸荧光酯 FITC |
人肠平滑肌细胞 | 固蓝BB盐 |
人脐静脉血管内皮细胞 | 人小肠黏膜上皮细胞固蓝RR盐 |
人小肠细胞 | 乙基紫 |
标准胎牛血清 | 赤藓红B |

一、取材与分离
1. 快速操作
- 组织取材后需立即处理,避免长时间暴露于室温或非营养环境。
- 使用无菌 PBS 或生理盐水冲洗组织,去除血液、杂质。
2. 消化酶选择
- 根据组织类型选择消化酶,避免过度消化导致细胞损伤。
- 消化时间需严格控制(通常 10-30 分钟),可通过显微镜观察细胞解离状态。
二、培养条件优化
1. 培养基选择
- 使用含血清或特定生长因子的培养基(如 DMEM、RPMI 1640 等),部分细胞需添加胰岛素、EGF 等。
- 避免频繁更换培养基品牌或批次,减少细胞适应压力。
2. 贴壁与传代
- 原代细胞贴壁能力较弱,可能需要包被培养皿(如胶原蛋白、多聚赖氨酸)。
- 传代时密度建议控制在 70%-80%,过度汇合会导致接触抑制和分化。
三、污染控制
1. 无菌操作
- 全程在超净台操作,使用一次性耗材,避免交叉污染。
- 培养基中可添加双抗,但长期使用可能影响细胞活性。
2. 支原体检测
- 定期检测支原体污染(如 PCR 法),污染后需及时丢弃细胞。
四、状态监控
1. 日常观察
- 每天检查细胞形态、密度及培养基颜色,及时更换培养基(通常每 2-3 天换液一次)。
- 异常形态(如细胞变圆、碎片增多)可能提示污染或营养不足。
2. 传代与冻存
- 原代细胞分裂次数有限(一般 5-10 代),需及时冻存早期代次细胞。
- 冻存液建议使用 DMSO+血清(或专用冻存培养基),梯度降温后液氮保存。