

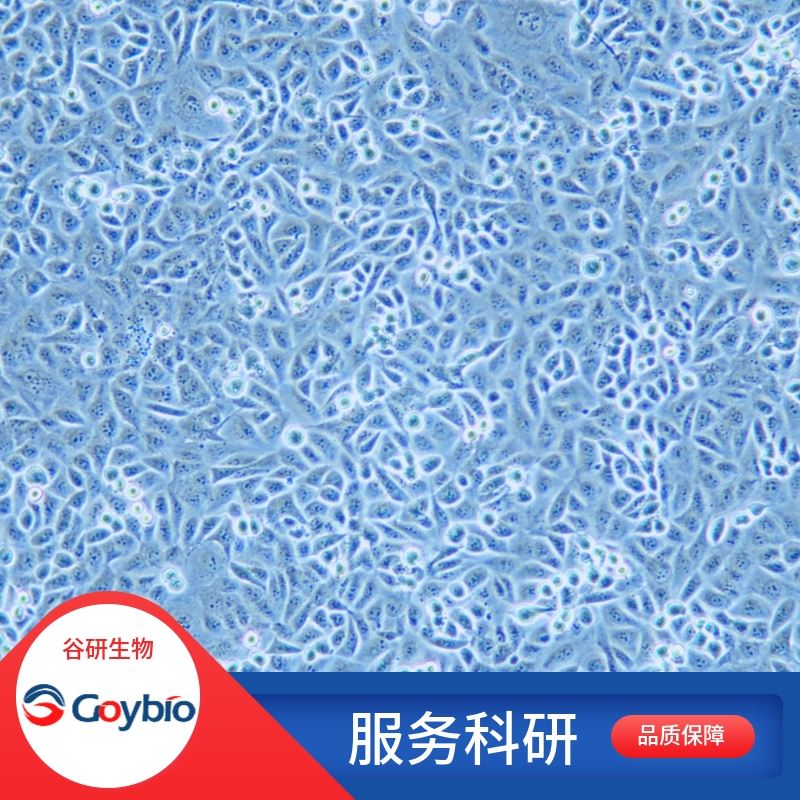



兔关节软骨细胞

规格 | 5×10⁵ | 货号 | GOY-01X0683 |
包装 | T25培养瓶 | 分类 | 兔原代细胞 |
生长特性 | 贴壁 | 组织来源 | 关节软骨组织 |

培养基 含FBS、生长添加剂、Penicillin、Streptomycin等
换液频率 每3-4天换液一次
生长特性 贴壁
细胞形态 梭形、多角形
传代特性 可传5代左右;3代以内状态
消化液 0.25%yi蛋白酶
培养条件 气相:空气,95%;CO2,5%


兔关节软骨分离自关节软骨组织;关节软骨属于透明软骨,表面光滑、呈淡蓝色、有光泽,它是由一种特殊的叫做致密结缔组织的胶原纤维构成的基本框架,这种框架呈半环形,类似拱形球门,其底端紧紧附着在下面的骨质上,上端朝向关节面,这种结构使关节软骨紧紧与骨结合起来而不会掉下来,同时当受到压力时候,还可以有少许的变形,起到缓冲压力的作用。在这些纤维之间,散在分布着软骨细胞,软骨细胞由浅层向深层逐渐由扁平样至椭圆或圆形的细胞组成,这些软骨细胞维持关节软骨的正常代谢。关节软骨没有神经支配,也没有血管,其营养成分必须从关节液中取得,而其代谢废物也必须排至关节液中,关节软骨的这种营养代谢必须通过关节运动,使关节软骨不断的受到压力刺激才行,所以关节运动对于维持关节软骨的正常结构起重要的作用。关节软骨细胞位于关节软骨陷窝内。幼稚的关节软骨细胞位于关节软骨组织的表层,单个分布、体积较小、呈椭圆形,长轴与关节软骨表面平行,越向深层的关节软骨细胞体积之间增大呈圆形,细胞核圆形或卵圆形、染色浅,细胞质弱嗜碱性,常见数量不一的脂滴。成熟的关节软骨细胞多2-8个成群分布于关节软骨陷窝内,这些关节软骨细胞由同一个母细胞分裂增殖而成,称为同源细胞群。电镜下,关节软骨细胞有突起和皱褶,细胞质内有大量的粗面内质网和发达的高尔基复合体及少量的线粒体。在组织切片中,关节软骨细胞收缩为不规则形,在软骨囊和细胞之间出现较大的腔隙。体外培养的关节软骨细胞对于研究其生理功能、药物作用以及各种致病因素作用下的病理生理改变具重要意义。
方法简介:
公司实验室分离的兔关节软骨采用胶原酶联合中性dan白酶消化制备而来,细胞总量约为5×10?cells/瓶。
质量检测:
公司实验室分离的兔关节软骨经Ⅱ型胶原蛋白免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。

一、细胞培养
1取材 在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的培养称为原代培养。2培养 将取得的组织细胞接入培养瓶或培养板中的过程称为培养。3冻存及复苏(可参阅后面有关章节)为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。
二、原代细胞分离
凡是来源于胚胎、组织器官及外周血,经特殊分离方法制备而来的原初培养的细胞称之为原代细胞。1悬浮细胞的分离方法组织材料若来自血液、羊水、胸水或腹水的悬液材料,的方法是采用1000r/min的低速离心10分钟。经离心后由于各种细胞的比重不同可在分层液中形成不同层,这样可根据需要收获目的细胞。2实体组织材料的分离方法对于实体组织材料,由于细胞间结合紧密,为了使组织中的细胞充分分散,形成细胞悬液,可采用机械分散法(物理裂解)和消化分离法。
三、细胞增殖检测技术
目前主要有两种用于检测细胞增殖能力的方法。一种是直接的方法,通过直接测定进行分裂
的细胞数来评价细胞的增殖能力。另一种是间接的方法,即细胞活力(cell viability)检测方法,通过检测样品中健康细胞的数目来评价细胞的增殖能力。显然,细胞活力检测法并不能最终证明检测样品中的细胞是否在增殖。如细胞在某一培养条件下会自发启动凋亡程序,但药物的干扰可抑制凋亡的发生;这时若采用细胞活力检测法,显然可以区分两种条件下的细胞数量,但我们并不能从药物干扰组细胞数大于对照组的事实说明药物可促进细胞增殖的结论。所以最直接的证据应该采用方法一。

![]()
取材:首先,用培养液湿润所取的组织材料,并用锋利的眼科剪去除附在其上的脂肪和结缔组织。接着用平衡液(如PBS或Hanks液)漂洗,再用眼科弯剪将组织块剪成小块。多次用PBS或Hanks液漂洗,直到液体清亮、无油滴为止。
接种:用湿润的吸管吸取切碎的组织块,轻轻吹到培养瓶皿中,并按一定间距均匀放在培养瓶底壁上。注意不要过多,确保组织块切面贴在培养瓶底壁上。
培养:将培养瓶翻转,使瓶底朝上,在种植了组织块一侧的对侧面加足培养液,避免组织块与培养液接触,然后塞紧瓶塞。将种植了组织块的一侧朝上,静置于37℃培养箱中。待组织块贴壁1到3小时后翻瓶,使贴壁的组织块浸没在培养液中,继续静置。换液:每隔2到3天更换一次培养液,或者根据培养瓶种颜色的变化确定换液时间。
一、原代细胞计数
将血球计数板及盖片用擦试干净,并将盖片盖在计数板上。
将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间。
静置3分钟。
镜下观察,计算计数板四大格细胞总数,压线细胞只计左侧和上方的。然后按下式计算:
细胞数/ml=4大格细胞总数/ 4×10000
注意:镜下偶见由两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团占10%以上,说明分散不好,需重新制备细胞悬液。
二、原代细胞活力
将细胞悬液以0.5ml加入试管中。
加入0.5ml 0.4%台盼兰染液,染色2一3分钟。
吸取少许悬液涂于载玻片上,加上盖片。
镜下取几个任意视野分别计死细胞和活细胞数,计细胞活力。
死细胞能被台盼兰染上色,镜下可见深兰色的细胞,活细胞不被染色,镜下呈无色透明状。
活力测定可以和细胞计数合起来进行,但要考虑到染液对原细胞悬液的加倍稀释作用。

小鼠垂体瘤细胞AtT-20(种属鉴定) | 人急性原粒细胞白血病细胞 KASUMI-1(STR鉴定正确) |
人骨肉瘤细胞HOS(STR鉴定正确) | 乙酰吉它霉 |
人正常结肠上皮细胞NCM-460(STR鉴定正确) | Anhydrotetracycline 脱水四环 |
小鼠小脑细胞 C8-D1A(种属鉴定) | 4-差向金霉 |
人淋巴细胞白血病细胞A3(STR鉴定正确) | 脱水差向四环 |
人大细胞肺癌耐药株NCI-H460/cis (STR鉴定正确) | β- |
人外周血嗜碱性白血病细胞 KU812 (STR鉴定正确) | 苄西林 |
小鼠脑神经瘤细胞Luciferase荧光稳转株 | 新霉胺 |
大鼠输尿管平滑肌细胞 | 巴龙霉 |
人卵巢癌TOV21G(STR鉴定正确) | 醋麦迪霉 |
人肺癌细胞带绿色荧光 A549+GFP (STR鉴定正确) | 丙交沙霉 |
人胃癌细胞Hs-746T (STR鉴定正确) | 克拉霉 供效价测定用 |
人乳腺癌细胞带红色荧光MDA-MB-231+RFP(STR鉴定正确) | 兔关节软骨细胞奈替米星 |
人乳腺癌细胞MDA-MB-453(STR鉴定正确) | 大观霉 供效价测定用 |
Transwell-24膜嵌套,6.5mm直径,3.0um孔径PC膜,PC(聚碳酯)灭菌 | 阿奇霉 效价测定用 |