

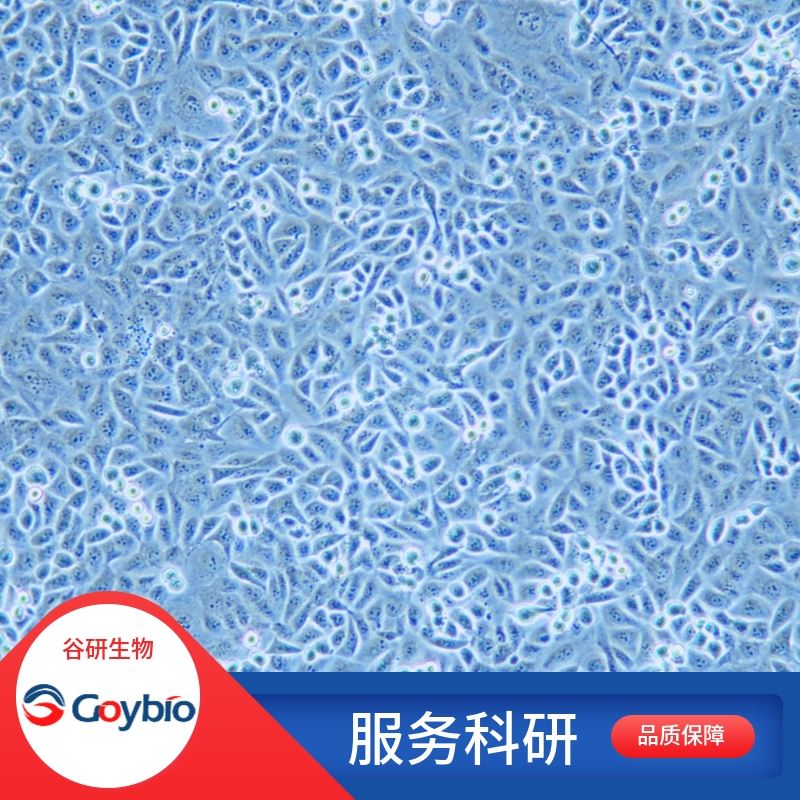



兔气管上皮细胞

包被条件 鼠尾胶原Ⅰ(2-5μg/cm2)
培养基 含FBS、生长添加剂、Penicillin、Streptomycin等
换液频率 每2-3天换液一次
生长特性 贴壁
细胞形态 上皮细胞样
传代特性 可传1-2代
消化液 0.25%yi蛋白酶
培养条件 气相:空气,95%;CO2,5%

规格 | 5×10⁵ | 货号 | GOY-01X0776 |
包装 | T25培养瓶 | 分类 | 兔原代细胞 |
生长特性 | 贴壁 | 组织来源 | 气管 |

兔气管上皮分离自气管组织;气管(Trachea),呼吸器官的一部分;为后壁略平的圆筒型管状。上端平第六颈椎下缘,与环状软骨相连;向下至第四、五胸椎体(相当胸骨角平面)交界处,分左、右主支气管,分叉处称为气管杈。气管主要由14-16个半环状软骨构成,有弹性,软骨为“C"字形的软骨环,缺口向后,各软骨环以韧带连接起来,环后方缺口处由平滑肌和致密结缔组织连接,保持了持续张开状态。管腔衬以粘膜,表面覆盖纤毛上皮,粘膜分泌的粘液可粘附吸入空气中的灰尘颗粒,纤毛不断向咽部摆动将粘液与灰尘排出,以净化吸入的气体。气管上皮是气道与外界环境接触的道防线,不仅是各种病原体、炎症介质作用的靶细胞,还作为效应细胞合成、释放多种炎性介质和细胞因子从而参与气道炎症及免疫反应。体外培养的原代气管上皮细胞因与体内组织在形态结构和功能活动上存在很大的相似性,因此,在基础及临床研究中极为重要。
方法简介:
公司实验室分离的兔气管上皮采用链霉蛋白-中性蛋白混合消化法结合差速贴壁法,并通过上皮细胞专用培养基培养筛选制备而来,细胞总量约为5×10?cells/瓶。
质量检测:
公司实验室分离的兔气管上皮经PCK免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。


一、细胞培养
1取材 在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的培养称为原代培养。2培养 将取得的组织细胞接入培养瓶或培养板中的过程称为培养。3冻存及复苏(可参阅后面有关章节)为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。
二、原代细胞分离
凡是来源于胚胎、组织器官及外周血,经特殊分离方法制备而来的原初培养的细胞称之为原代细胞。1悬浮细胞的分离方法组织材料若来自血液、羊水、胸水或腹水的悬液材料,的方法是采用1000r/min的低速离心10分钟。经离心后由于各种细胞的比重不同可在分层液中形成不同层,这样可根据需要收获目的细胞。2实体组织材料的分离方法对于实体组织材料,由于细胞间结合紧密,为了使组织中的细胞充分分散,形成细胞悬液,可采用机械分散法(物理裂解)和消化分离法。
三、细胞增殖检测技术
目前主要有两种用于检测细胞增殖能力的方法。一种是直接的方法,通过直接测定进行分裂
的细胞数来评价细胞的增殖能力。另一种是间接的方法,即细胞活力(cell viability)检测方法,通过检测样品中健康细胞的数目来评价细胞的增殖能力。显然,细胞活力检测法并不能最终证明检测样品中的细胞是否在增殖。如细胞在某一培养条件下会自发启动凋亡程序,但药物的干扰可抑制凋亡的发生;这时若采用细胞活力检测法,显然可以区分两种条件下的细胞数量,但我们并不能从药物干扰组细胞数大于对照组的事实说明药物可促进细胞增殖的结论。所以最直接的证据应该采用方法一。

![]()
取材:首先,用培养液湿润所取的组织材料,并用锋利的眼科剪去除附在其上的脂肪和结缔组织。接着用平衡液(如PBS或Hanks液)漂洗,再用眼科弯剪将组织块剪成小块。多次用PBS或Hanks液漂洗,直到液体清亮、无油滴为止。
接种:用湿润的吸管吸取切碎的组织块,轻轻吹到培养瓶皿中,并按一定间距均匀放在培养瓶底壁上。注意不要过多,确保组织块切面贴在培养瓶底壁上。
培养:将培养瓶翻转,使瓶底朝上,在种植了组织块一侧的对侧面加足培养液,避免组织块与培养液接触,然后塞紧瓶塞。将种植了组织块的一侧朝上,静置于37℃培养箱中。待组织块贴壁1到3小时后翻瓶,使贴壁的组织块浸没在培养液中,继续静置。换液:每隔2到3天更换一次培养液,或者根据培养瓶种颜色的变化确定换液时间。
一、原代细胞计数
将血球计数板及盖片用擦试干净,并将盖片盖在计数板上。
将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间。
静置3分钟。
镜下观察,计算计数板四大格细胞总数,压线细胞只计左侧和上方的。然后按下式计算:
细胞数/ml=4大格细胞总数/ 4×10000
注意:镜下偶见由两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团占10%以上,说明分散不好,需重新制备细胞悬液。
二、原代细胞活力
将细胞悬液以0.5ml加入试管中。
加入0.5ml 0.4%台盼兰染液,染色2一3分钟。
吸取少许悬液涂于载玻片上,加上盖片。
镜下取几个任意视野分别计死细胞和活细胞数,计细胞活力。
死细胞能被台盼兰染上色,镜下可见深兰色的细胞,活细胞不被染色,镜下呈无色透明状。
活力测定可以和细胞计数合起来进行,但要考虑到染液对原细胞悬液的加倍稀释作用。

人食管癌细胞OE19(STR鉴定正确) | 小鼠黑色瘤带荧光B16+luc(种属鉴定) |
人胚肺细胞NCI-H1563(STR鉴定正确) | 二甲硫基甲烷 |
小鼠原B细胞株 BA/F3(种属鉴定) | 苯并噻唑 |
人肺癌细胞NCI-H2122(STR鉴定正确) | 2,5-双(4-二乙氨基苯基)-1,3,4-恶二唑 |
人原髓细胞白血病细胞HL-60(STR鉴定正确) | 莫诺苯宗 |
(小鼠骨髓(未成熟)树突状细胞) JAWSII | 乙钴,四水 |
人甲状腺癌乳头状细胞 Bcpap(STR鉴定正确) | 4-氯苯乙 |
小鼠肾足细胞 | DL-苹果钙 |
小鼠胚胎肝细胞BNL CL.2(种属鉴定) | 1-溴代萘 |
293T过表达ACE2细胞株 293T/ACE2 (STR鉴定正确) | 俾氏麦棕Y |
人微血管内皮细胞株HMEC-1(STR鉴定正确) | 氨基甲丁酯 |
人喉癌细胞 LCC(STR鉴定正确) | 苯并红紫4B |
人卵巢癌细胞HO-8910(STR鉴定正确) | 兔气管上皮细胞比伐卢定(TFA) |
人B淋巴瘤细胞Farage(STR鉴定正确) | 1,1'-双(二苯基膦)二茂铁 |
BC-1215 | 1,3-双(二苯膦基)丙烷 |