



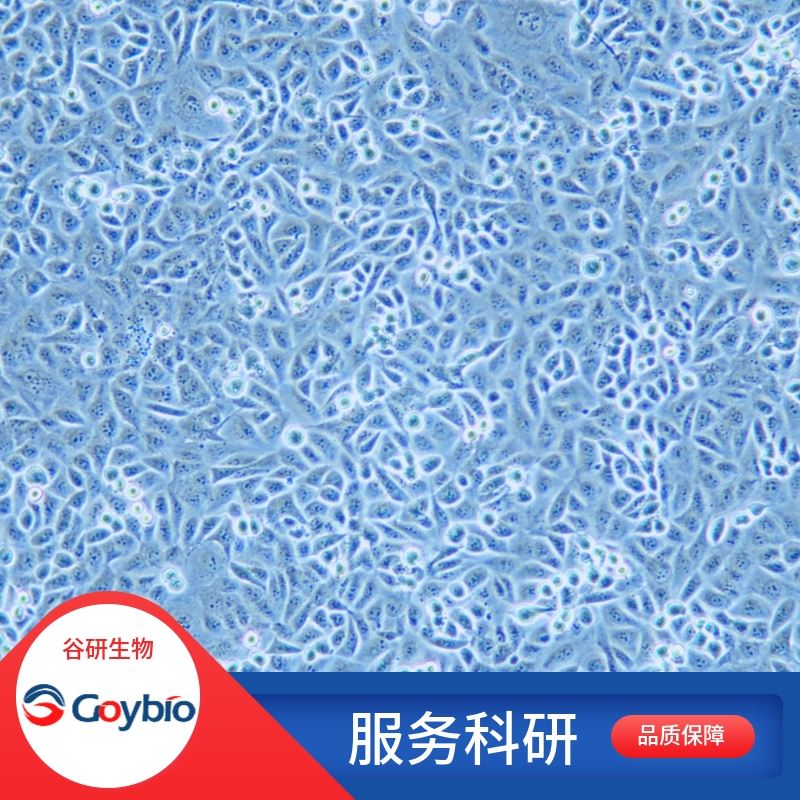

兔脊髓神经元细胞

规格 | 5×10⁵ | 货号 | GOY-01X0900 |
包装 | T25培养瓶 | 分类 | 兔原代细胞 |
生长特性 | 贴壁 | 组织来源 | 脊髓组织 |

包被条件 PLL(0.1mg/ml)
培养基 含B-27 Supplement、Penicillin、Streptomycin等
换液频率 每2-3天换液一次
生长特性 贴壁
细胞形态 神经元细胞样
传代特性 属于终末分化细胞;属于不增殖细胞群
消化液 0.25%yi蛋白酶
培养条件 气相:空气,95%;CO2,5%


兔脊髓神经元分离自脊髓组织;脊髓是细细的管束状的神经结构,位于脊柱的椎管内且被脊椎保护;是源自脑的中枢神经系统延伸部分。中枢神经系统的细胞依靠复杂的联系来处理传递信息。脊髓的主要功能是传送脑与外周之间的神经信息。人和脊椎动物中枢神经系统的一部分,在椎管里面,上端连接延髓,两旁发出成对的神经,分布到四肢、体壁和内脏。脊髓的内部有一个H形(蝴蝶型)灰质区,主要由神经细胞构成;在灰质区周围为白质区,主要由有髓神经纤维组成;脊髓是许多简单反射的中枢。脊髓两旁发出许多成对的神经(称为脊神经)分布到全身皮肤、肌肉和内脏器官。脊髓是周围神经与脑之间的通路,也是许多简单反射活动的低级中枢。按脊神经的出入可把脊髓也分为相应的31节,31对脊神经就是由不同的脊椎发出的。神经系统最基本的结构和功能单位是神经元,即神经细胞,其大小和外观在中枢神经系统中差异很大。但都具有胞体和树突、轴突。胞体又叫核周体,内含神经丝、微管、内质网、游离核糖体和一个有明显核仁的核。一些大神经元突起的粗面内质网可用Nissl染色显示,在光镜下是灰蓝色斑块状,称为尼氏小体。树突和轴突是神经元的突起,能在神经元之间传递电冲动,突起的大小和形态各不相同,很难用常规的显微镜鉴别。脊髓组织内含有大量胶质细胞,神经元含量少,分离纯化难度大,且脊髓神经元细胞是高度分化的终末细胞,不能分裂增殖,培养要求高。刚接种的脊髓神经元呈圆形,体积小,透亮,无突起。培养2-3d,可见胞体增大,突起增多延长;培养6-7d,细胞体大饱满,突起明显增加延长并交织成网,光晕明显,立体感强。培养20d后,死亡细胞明显增加,细胞出现内空泡,突起粗细不均,甚至脱壁,发生细胞崩解。
方法简介:
公司实验室分离的兔脊髓神经元采用胶原酶&联合消化法、神经元专用培养基培养筛选结合化学试剂抑制法制备而来,细胞总量约为5×10?cells/瓶。
质量检测:
公司实验室分离的兔脊髓神经元经β-Tubulin免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。

一、细胞培养
1取材 在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的培养称为原代培养。2培养 将取得的组织细胞接入培养瓶或培养板中的过程称为培养。3冻存及复苏(可参阅后面有关章节)为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度-196℃,将细胞收集至冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,最终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。
二、原代细胞分离
凡是来源于胚胎、组织器官及外周血,经特殊分离方法制备而来的原初培养的细胞称之为原代细胞。1悬浮细胞的分离方法组织材料若来自血液、羊水、胸水或腹水的悬液材料,的方法是采用1000r/min的低速离心10分钟。经离心后由于各种细胞的比重不同可在分层液中形成不同层,这样可根据需要收获目的细胞。2实体组织材料的分离方法对于实体组织材料,由于细胞间结合紧密,为了使组织中的细胞充分分散,形成细胞悬液,可采用机械分散法(物理裂解)和消化分离法。
三、细胞增殖检测技术
目前主要有两种用于检测细胞增殖能力的方法。一种是直接的方法,通过直接测定进行分裂
的细胞数来评价细胞的增殖能力。另一种是间接的方法,即细胞活力(cell viability)检测方法,通过检测样品中健康细胞的数目来评价细胞的增殖能力。显然,细胞活力检测法并不能最终证明检测样品中的细胞是否在增殖。如细胞在某一培养条件下会自发启动凋亡程序,但药物的干扰可抑制凋亡的发生;这时若采用细胞活力检测法,显然可以区分两种条件下的细胞数量,但我们并不能从药物干扰组细胞数大于对照组的事实说明药物可促进细胞增殖的结论。所以最直接的证据应该采用方法一。

![]()
取材:首先,用培养液湿润所取的组织材料,并用锋利的眼科剪去除附在其上的脂肪和结缔组织。接着用平衡液(如PBS或Hanks液)漂洗,再用眼科弯剪将组织块剪成小块。多次用PBS或Hanks液漂洗,直到液体清亮、无油滴为止。
接种:用湿润的吸管吸取切碎的组织块,轻轻吹到培养瓶皿中,并按一定间距均匀放在培养瓶底壁上。注意不要过多,确保组织块切面贴在培养瓶底壁上。
培养:将培养瓶翻转,使瓶底朝上,在种植了组织块一侧的对侧面加足培养液,避免组织块与培养液接触,然后塞紧瓶塞。将种植了组织块的一侧朝上,静置于37℃培养箱中。待组织块贴壁1到3小时后翻瓶,使贴壁的组织块浸没在培养液中,继续静置。换液:每隔2到3天更换一次培养液,或者根据培养瓶种颜色的变化确定换液时间。
一、原代细胞计数
将血球计数板及盖片用擦试干净,并将盖片盖在计数板上。
将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间。
静置3分钟。
镜下观察,计算计数板四大格细胞总数,压线细胞只计左侧和上方的。然后按下式计算:
细胞数/ml=4大格细胞总数/ 4×10000
注意:镜下偶见由两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团占10%以上,说明分散不好,需重新制备细胞悬液。
二、原代细胞活力
将细胞悬液以0.5ml加入试管中。
加入0.5ml 0.4%台盼兰染液,染色2一3分钟。
吸取少许悬液涂于载玻片上,加上盖片。
镜下取几个任意视野分别计死细胞和活细胞数,计细胞活力。
死细胞能被台盼兰染上色,镜下可见深兰色的细胞,活细胞不被染色,镜下呈无色透明状。
活力测定可以和细胞计数合起来进行,但要考虑到染液对原细胞悬液的加倍稀释作用。

COV434人卵巢颗粒肿瘤细胞 | CW-2人结肠癌细胞 |
cx-1结肠癌细胞 | S-腺苷-L-同型半胱氨水解酶(SAHH) |
D283 Med人脑髓母细胞瘤细胞 | 人中性粒细胞明胶酶相关载脂蛋白(NGAL) |
D341 Med人脑髓母细胞瘤细胞 | 人中性粒细胞明胶酶相关载脂蛋白抗体(NGAL抗体) |
DAMI人巨核细胞白血病细胞 | S腺苷甲硫氨合成酶(MAT) |
DAOY人髓母细胞瘤细胞 | 胱抑C(Cys C) |
DAUDI人Burkitt's淋巴瘤细胞 | 胱硫醚β裂解酶(Cystathionine beta-lyase CBL) |
小鼠杂交瘤细胞;1H8 | 高铁螯合物还原酶(FCR)活性检测试剂盒 |
DLD-1人结直肠腺癌细胞 | 同型半胱氨甲基转移酶(HMT) |
DMS 53人肺癌细胞 | 玫瑰醚 |
DMS 114人小细胞肺癌细胞 | 2-甲基-3-庚酮 |
DU145人前列腺癌细胞 | 高黄芩四甲醚 |
EA.hy926人脐静脉细胞融合细胞 | 兔脊髓神经元细胞羟基芫花 |
Eca-109人食管癌细胞 | γ-胡萝卜 |
砷甜菜碱溶液标准物质 | 4-姜酚 |